北京百奥思科生物医学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
公司新闻/正文
Co-IP精准拿捏蛋白"最佳搭子"
15 人阅读发布时间:2026-01-28 14:13
一、实验原理
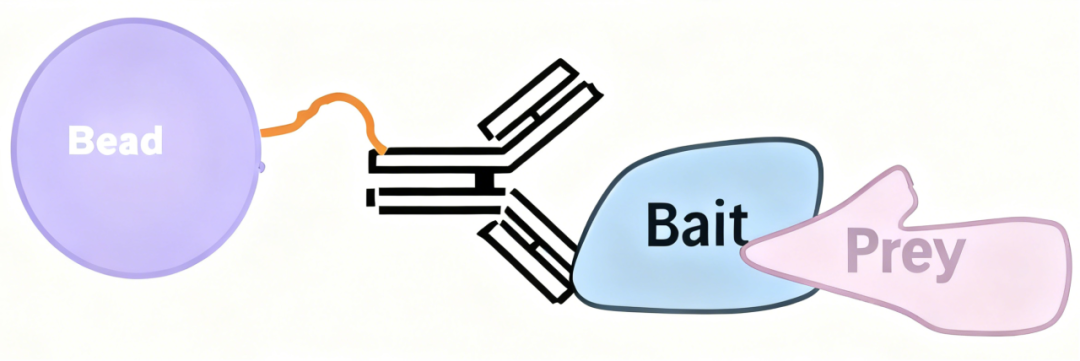
Co-IP基于抗原-抗体特异性结合的原理,实现对目标蛋白及其互作蛋白的捕获与鉴定。
其核心步骤包括:
靶蛋白捕获:利用特异性抗体识别并结合溶液中的目标蛋白(Bait protein),形成抗原-抗体免疫复合物。
互作蛋白共沉淀:与靶蛋白直接或间接结合的其他蛋白质(Prey protein)随免疫复合物被一同沉淀。
复合物分离与检测:通过离心等方式分离复合物,进一步采用Western Blot、质谱分析等技术对共沉淀蛋白进行定性与鉴定。
技术优势:
✔在接近生理条件下研究蛋白质相互作用,有助于保持蛋白质天然构象及复合物完整性;
✔适用于内源性蛋白互作研究,无需对目标蛋白进行人工修饰或标记;
✔广泛应用于信号转导、病毒-宿主互作、转录复合物组装等多个研究领域;

二、实验流程示意图与解析
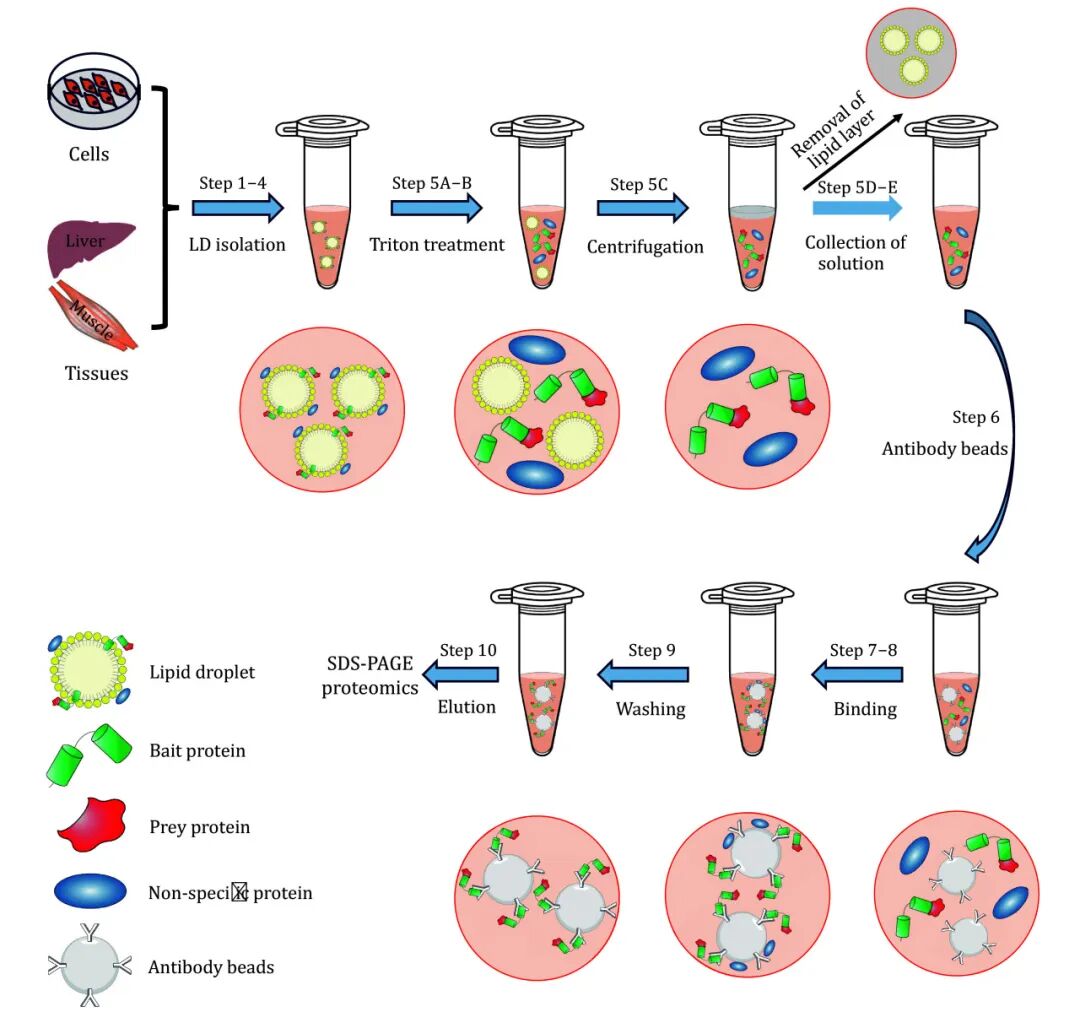
(图片来源PMID_38774355)
假设脂滴表面存在已知蛋白A(Bait,绿色标示),推测其可能与蛋白B(Prey,红色标示)发生相互作用。若该推测成立,则在脂滴移除后的裂解液中应存在“A-B蛋白复合体”。
Co-IP实验通过使用蛋白A的特异性抗体(Anti-A)与细胞裂解液共孵育,形成“蛋白A-抗体”复合物。随后加入可结合抗体Fc段的磁珠(Beads),进一步形成“蛋白A–抗体–磁珠”三元复合物。经磁性分离与洗涤去除非特异性结合后,沉淀中应包含蛋白A、蛋白B及抗体。
将所得复合物进行Western Blot检测,若可见蛋白A与蛋白B的特异性条带,则证明两者存在相互作用;反之则提示推测有误或实验过程中存在技术问题。
三、典型结果示例
如果蛋白A和蛋白B有相互作用,那么通过western blot可以分别检测到蛋白A和蛋白B的条带。以下是一个最基本的结果示例图:
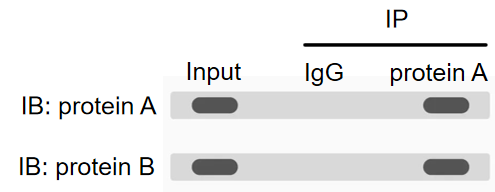
阳性对照:Input组,细胞裂解后得到的总蛋白,所以包括蛋白A和蛋白B,使用对应的抗体能分别看到条带。
阴性对照:使用非特异性IgG抗体进行沉淀,理论上不应检测到目标条带,用于排除非特异性结合。
实验样本:使用Anti-A抗体进行共沉淀,若同时检出蛋白A与蛋白B条带,则证实两者存在相互作用。

四、Co-IP条带缺失的可能原因?
1. 蛋白浓度过低
细胞裂解液蛋白浓度过低是导致Co-IP失败的关键因素之一。建议尽量使用高浓度裂解液,避免过度稀释。
2. 抗体适用性问题
Co-IP实验需选用经过验证的免疫沉淀级别抗体。单克隆抗体特异性高但识别表位单一,若该表位被遮蔽可能导致实验失败;多克隆抗体识别多个表位,容错性更高,建议在表位信息不明确时优先选用。
3. 实验体系配比不当
蛋白、抗体与磁珠的用量需严格优化。常规推荐比例为:每100μg总蛋白使用3μg抗体与30μl磁珠悬浮液,具体需根据实验体系进行调整。
4. 细胞数量不足
细胞量过低将导致目标蛋白含量不足。建议使用培养面积不少于145mm的培养皿,细胞融合度达50%以上为宜。
5. 裂解效率不佳
裂解液强度不足可能导致蛋白复合物未能充分解离。可尝试提高裂解液离子强度,或添加适量SDS(≤0.1%)以增强变性能力,但需注意SDS浓度过高可能影响抗体结合。

五、总结
Co-IP(共免疫沉淀)技术成功的关键在于:
✔高质量的抗体:需使用经验证的IP级抗体;
✔优化的实验体系:包括足够的细胞量、适宜的蛋白浓度以及精准的抗体、磁珠比例;
✔充分的裂解效率:确保蛋白复合物被有效释放。