北京百奥思科生物医学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.7999999999999998
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
公司新闻/正文
文献分享 | 南京中医药大学将中药活性成分与国自然热点“血管生成”和“糖酵解”结合,国自然思路,拿走不谢~
716 人阅读发布时间:2024-04-12 09:54
今天给大家带来的是今年2月份南京中医药大学陆茵、赵杨教授团队发表在Acta Pharmaceutica Sinica B(IF:14.5)上的研究Targeting PKM2 signaling cascade with salvaianic acid A normalizes tumor blood vessels to facilitate chemotherapeutic drug delivery。该研究将中药活性成分与国自然热点“血管生成”和“糖酵解”结合,而且使用了测序和分子对接等技术,最终揭示了活血化瘀中药丹参主要活性成分丹参素通过调控关键激酶PKM2抑制内皮细胞糖代谢,并通过β-Catenin/Claudin-5信号级联增强内皮细胞间紧密连接。

题目:使用丹酚酸A靶向PKM2信号级联可使肿瘤血管正常化以促进化疗药物输送
杂志:Acta Pharmaceutica Sinica B
影响因子:14.5
发表日期:2024.2
研究背景
异常的肿瘤血管容易推动肿瘤的恶性进展,靶向肿瘤内皮细胞的异常代谢是实现血管正常化和拮抗肿瘤进展的一种有前景的选择。丹参酸A(SAA)是丹参的主要生物活性成分,已被证明具有抗氧化、抗炎和抗癌等多种药理功能。然而,SAA是否能够对调节肿瘤血管产生显著影响仍不明确。
研究思路
在本研究中,作者阐明丹酚酸 A (SAA) 在促进荷瘤小鼠血管正常化方面发挥着关键作用,从而改善化疗药物的递送和有效性。SAA 能够抑制糖酵解并增强暴露于缺氧的人脐静脉内皮细胞 (HUVEC) 中的内皮连接。从机制上讲,SAA 倾向于直接与糖酵解酶 PKM2 结合,导致内皮糖酵解急剧减少。SAA 通过以PKM2依赖性方式激活β-Catenin/Claudin-5信号轴来改善内皮完整性。
主要结果
SAA通过减轻缺氧微环境来延缓肿瘤进展
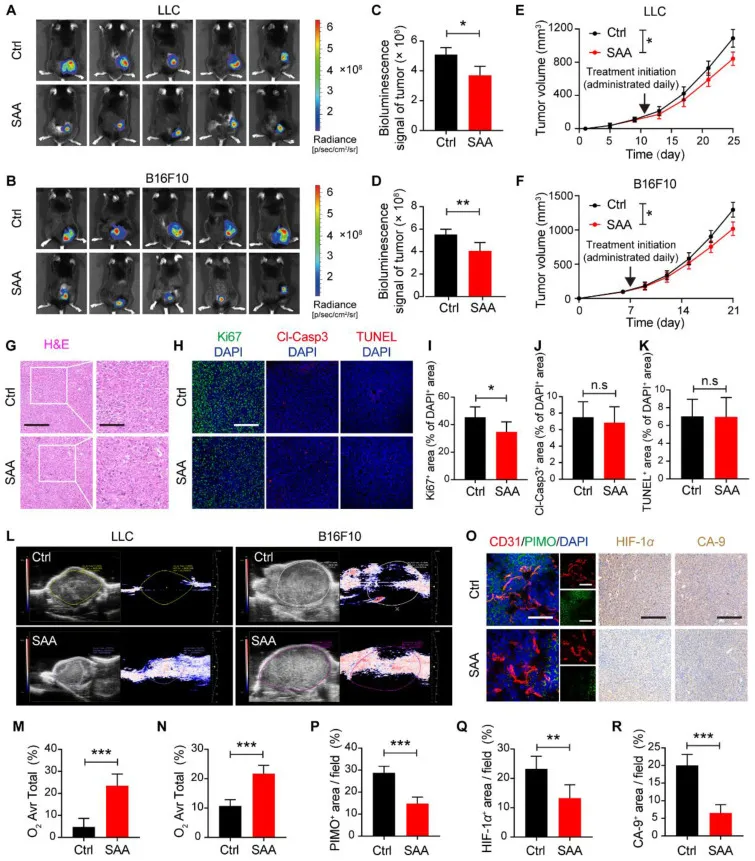
图1 SAA可延缓肿瘤进展。A-D:用载体 Ctrl 或 SAA (40 mg/kg) 处理的 LLC刘易斯肺癌) (A) 和 B16F10 (F10小鼠皮肤黑色素瘤)肿瘤 (B) 的生物发光图像以及 LLC (C) 和 B16F10 肿瘤 (D) 中生物发光信号的量化。E, F:LLC (E)和B16F10肿瘤(F) Ctrl和SAA处理小鼠的增长曲线。(G) SAA处理或未处理的LLC荷瘤小鼠肿瘤的代表性HE染色图像。(H)在SAA处理或未处理的LLC荷瘤小鼠中,Ki67(绿色)、Cl-Casp3(红色)和TUNEL(红色)与DAPI(蓝色)的代表性免疫荧光染色图像。I – K:定量分析SAA治疗前后LLC肿瘤中Ki67+ (I)、Cl-Casp3+ (J)和TUNEL+ (K)细胞占DAPI+细胞的百分比(n = 5)。L:LLC和B16F10肿瘤经Ctrl或SAA治疗后的代表性超声图像。M, N:LLC (M)和B16F10 (N)肿瘤(N = 3)中平均氧面积占总面积百分比的定量。(O) CD31(红色)、PIMO(绿色)和DAPI(蓝色)免疫荧光共染色的代表性图像,以及在有无SAA的情况下HIF-1α和CA-9免疫组织化学染色的代表性图像。P – R:LLC肿瘤中PIMO+面积百分比(P)、HIF-1α+面积百分比(Q)和CA-9+面积百分比(R)。
SAA可通过改善血管结构和功能使肿瘤血管正常化
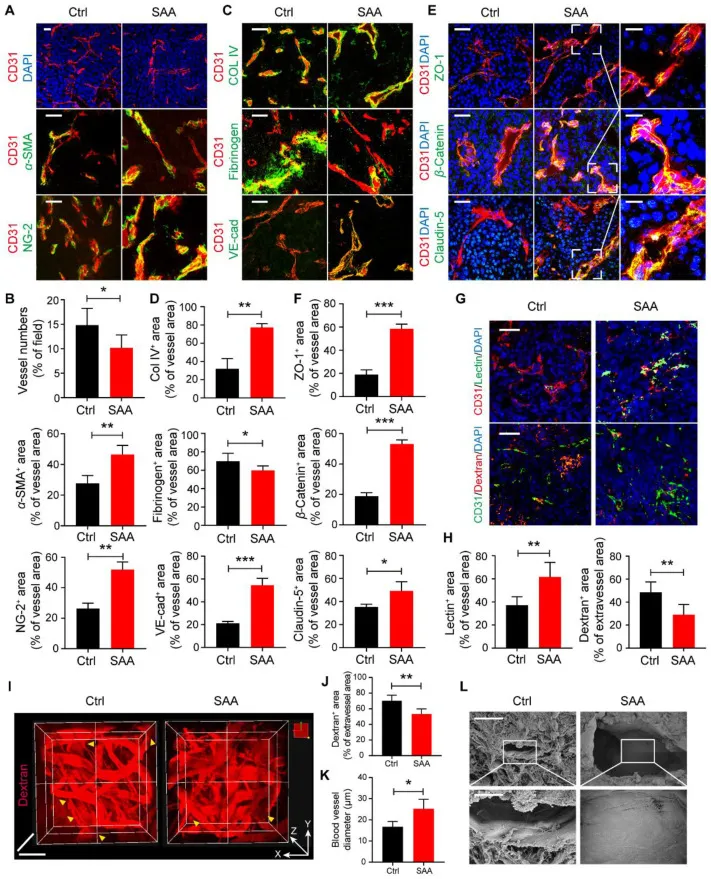
图2 SAA 引发肿瘤血管正常化。(A) 在用 Ctrl 和 SAA 治疗的 LLC 肿瘤中,CD31(红色)与 DAPI(蓝色)、α-SMA(绿色)或 NG-2(绿色)共染色的代表性免疫荧光图像。(B) LLC 肿瘤中血管数量以及 CD31+ α-SMA+ 区域和 CD31+ NG-2+ 区域的百分比的定量。(C) 在用 Ctrl 和 SAA 治疗的 LLC 肿瘤中,CD31(红色)与 Col IV(绿色)、纤维蛋白原(绿色)和 VE-cad(绿色)共染色的代表性免疫荧光图像。(D) LLC 肿瘤中 CD31+ Col IV+ 面积、CD31+ 纤维蛋白原 + 面积和 CD31+ VE-cad+ 面积百分比的定量。(E) 在用 Ctrl 和 SAA 治疗的 LLC 肿瘤中,CD31(红色)与 ZO-1(绿色)、β-Catenin(绿色)和 Claudin-5(绿色)共染色的代表性免疫荧光图像。(F) LLC 肿瘤中 CD31+ ZO-1+ 区域、CD31+ β-Catenin+ 区域和 CD31+ Claudin-5+ 区域百分比的定量。(G) 肿瘤血管中凝集素灌注(绿色)和葡聚糖泄漏(红色)的代表性免疫荧光图像(用 CD31 染色)。(H) 血管区域中凝集素 + 区域的百分比和血管外区域中葡聚糖 + 区域的百分比的定量 (n = 5)。(I) Ctrl 和 SAA 治疗组中静脉注射葡聚糖的 LLC 肿瘤的双光子活体显微镜图像。J, K:用 Ctrl 和 SAA 治疗的 LLC 荷瘤小鼠 (n = 4) 中血管外面积 (J) 的葡聚糖 + 面积和肿瘤血管直径 (K) 的定量。(L) LLC 肿瘤中肿瘤血管的代表性 SEM 图像。
SAA 加速缺氧引起的内皮连接破坏的恢复
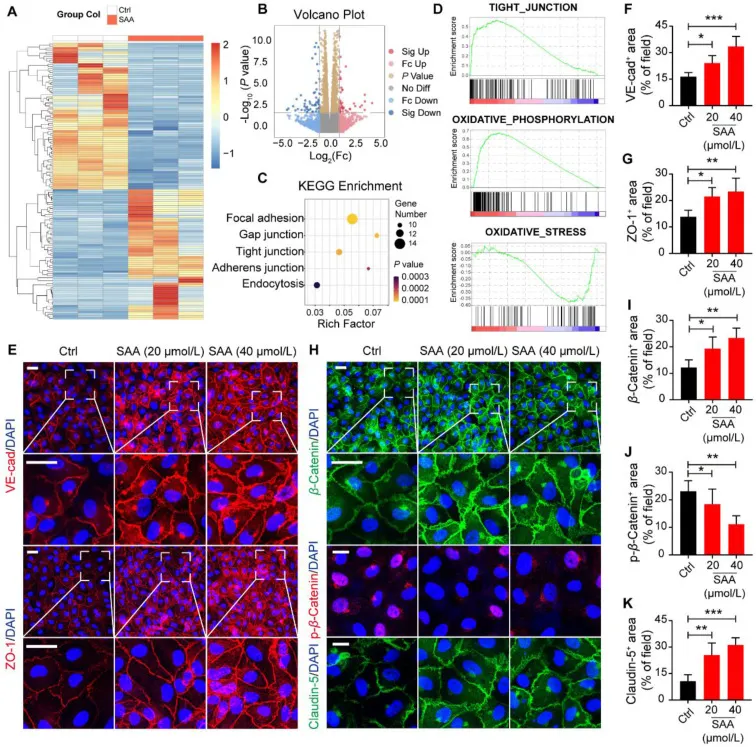
图3 SAA 加速缺氧引起的内皮连接破坏的恢复。(A) 热图显示缺氧诱导的 Ctrl 和 SAA 处理的 HUVEC 之间表达显着差异的基因。(B) 显示差异表达基因的火山图。(C) KEGG 富集分析显示基于不同表达基因的核心信号通路。(D) GSEA 用于分析属于紧密连接、氧化应激和氧化磷酸化的基因簇。(E) HUVEC 中 VE-cad(红色)/DAPI(蓝色)和 ZO-1(红色)/DAPI(蓝色)的代表性免疫荧光图像。F,G:视野中 VE-cad+ 区域 (F) 和 ZO-1+ 区域 (G) 百分比的量化。(H) HUVEC 中 β-Catenin(绿色)/DAPI(蓝色)、p-β-Catenin(红色)/DAPI(蓝色)和 Claudin-5(绿色)/DAPI(蓝色)的代表性免疫荧光图像。I–K:视野中 β-Catenin+ 区域 (I)、p-β-Catenin+ 区域 (J) 和 Claudin-5+ 区域 (K) 的百分比定量 (n = 6)。
SAA 抵消 EC 中缺氧引发的氧化应激和代谢重编程
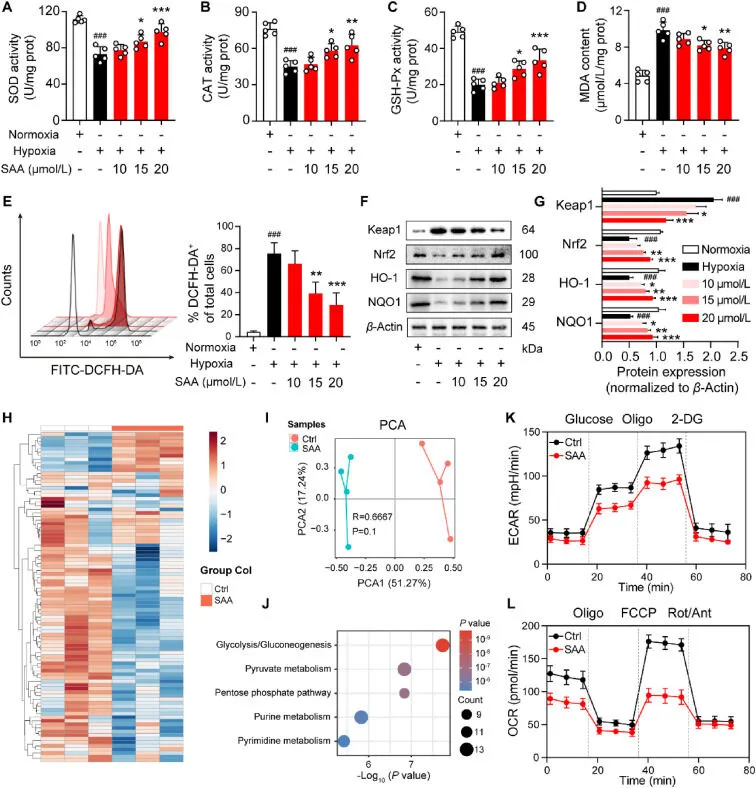
图4 SAA 抵消 EC 中缺氧引发的氧化应激和代谢重编程。A-D:经不同浓度 SAA 处理的缺氧刺激 HUVEC 中氧化应激标记物的含量,包括 SOD (A)、CAT (B)、GSH-Px (C) 和 MDA (D)(n = 5)。(E) 使用 DCFH-DA 荧光探针 (n = 3) 检测 ROS 的产生。(F) 通过蛋白质印迹分析测定 Keap1、Nrf2、HO-1 和 NQO1 的蛋白表达水平。(G) Keap1、Nrf2、HO-1 和 NQO1 蛋白表达水平的光密度比定量 (n = 3)。(H) 热图显示 Ctrl 和 SAA 处理的 HUVEC 在缺氧刺激下的代谢物存在显着差异。(I) Ctrl 和 SAA 处理组中缺氧刺激的 HUVEC 中代谢物的 PCA。(J) 代谢物的富集分析。K, L:通过海马测定对ECAR (K) 和 OCR (L) 值的代表性轨迹进行量化。
SAA 通过与 PKM2 结合限制内皮糖酵解
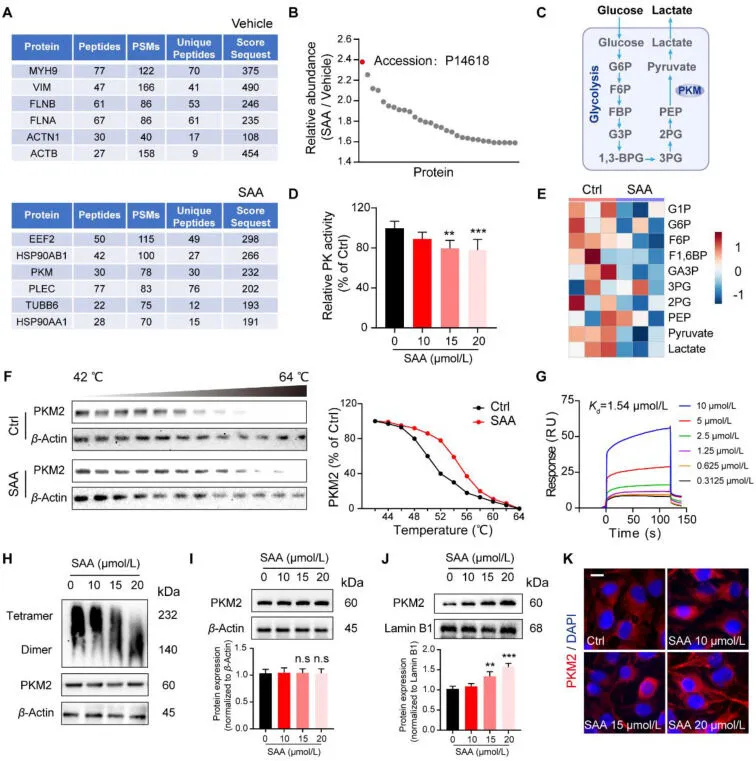
图5.SAA 通过与 PKM2 结合来限制内皮糖酵解。(A) 对相关蛋白进行基于 MS 的 DARTS 测序,以确定 SAA 的靶标。(B) SAA 靶蛋白候选物的相对丰度。(C) 糖酵解示意图。(D) 通过激酶试剂盒测量相对 PK 活性 (n = 5)。(E) 热图显示缺氧时 Ctrl 和 SAA 处理的 HUVEC 之间的糖酵解代谢物存在显着差异 (n = 3)。(F) HUVEC 在有或没有 SAA 的情况下孵育 2 小时,然后对细胞进行温度依赖性 CETSA 检测 PKM2。(G)通过SPR测量SAA与PKM2的结合亲和力。(H)用SAA处理细胞裂解物,然后进行非还原梯度凝胶电泳以检测PKM2的二聚化。(I) Western blot 分析显示胞质 PKM2 的蛋白表达。对胞质 PKM2 条带的光密度比进行了定量。(J) 蛋白质印迹分析显示核 PKM2 的蛋白表达。(K) 用不同浓度 SAA 处理的 HUVEC 中内源 PKM2(红色)/DAPI(蓝色)的免疫荧光图像。
SAA 增强 β-Catenin/Claudin-5 轴介导的内皮紧密连接(TJ)
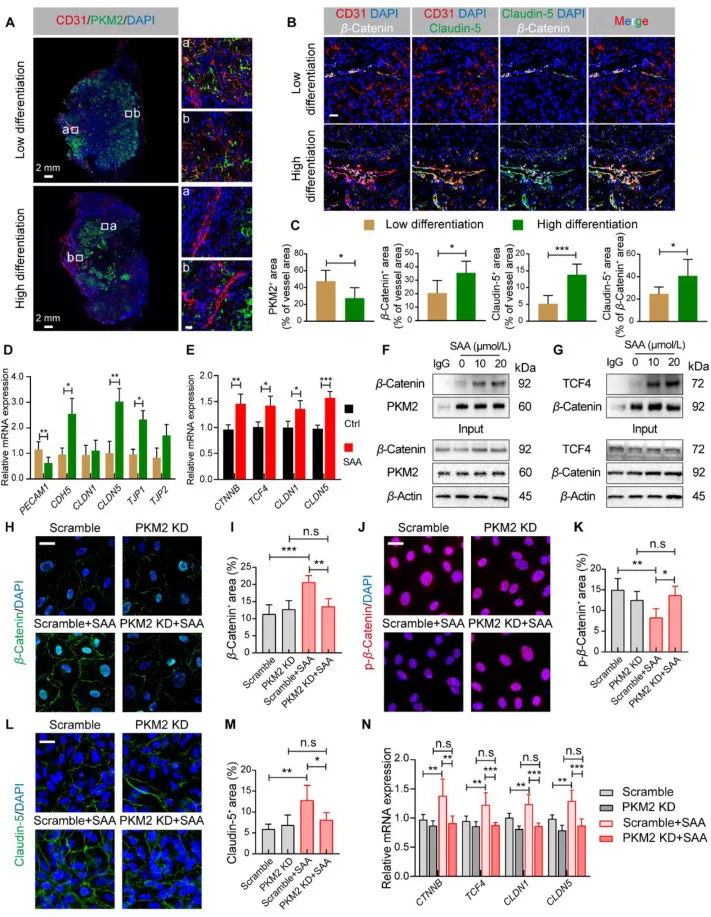
图7.SAA 增强 β-Catenin/Claudin-5 轴介导的内皮 TJ。(A) 人类肺癌样本中 CD31(红色)、PKM2(绿色)和 DAPI(蓝色)的代表性免疫荧光图像。(B) 人类肺癌样本中 CD31(红色)、Claudin-5(绿色)、β-Catenin(白色)和 DAPI(蓝色)的代表性免疫荧光图像。(C) 定量 CD31+ 与 PKM2+、β-Catenin+ 或 Claudin-5+ 区域的百分比以及 β-Catenin+ Claudin-5+ 区域的百分比(n = 4 或 5)。(D) 人肺癌组织中 PECAM1、CDH5、CLDN1、CLDN5、TJP1 和 TJP2 mRNA 表达水平的定量 (n = 4-6)。(E) 用或不用 SAA 处理的 HUVEC 中 CTNNB、TCF4、CLDN1 和 CLDN5 mRNA 表达水平的定量 (n = 4-6)。(F) HUVEC 中 β-Catenin 和 PKM2 的代表性 Co-IP 分析。(G) HUVEC 中 TCF4 和 β-Catenin 的代表性 Co-IP 分析。(H) HUVEC 中 β-连环蛋白(绿色)/DAPI(蓝色)的代表性免疫荧光图像。(I) 视野中 β-Catenin+ 区域百分比的定量 (n = 6)。(J) HUVEC 中 p-β-连环蛋白(红色)/DAPI(蓝色)的代表性免疫荧光图像。(K) 视野中 p-β-连环蛋白+ 区域百分比的定量 (n = 6)。(L) HUVEC 中 Claudin-5(绿色)/DAPI(蓝色)的代表性免疫荧光图像。(M) 视野中 Claudin-5+ 区域百分比的定量 (n = 6)。(N) 不同组 (n = 4-6) HUVEC 中 CTNNB、TCF4、CLDN1 和 CLDN5 mRNA 表达水平的定量。
SAA 促进 DOX 进入肿瘤并增强抗肿瘤效果
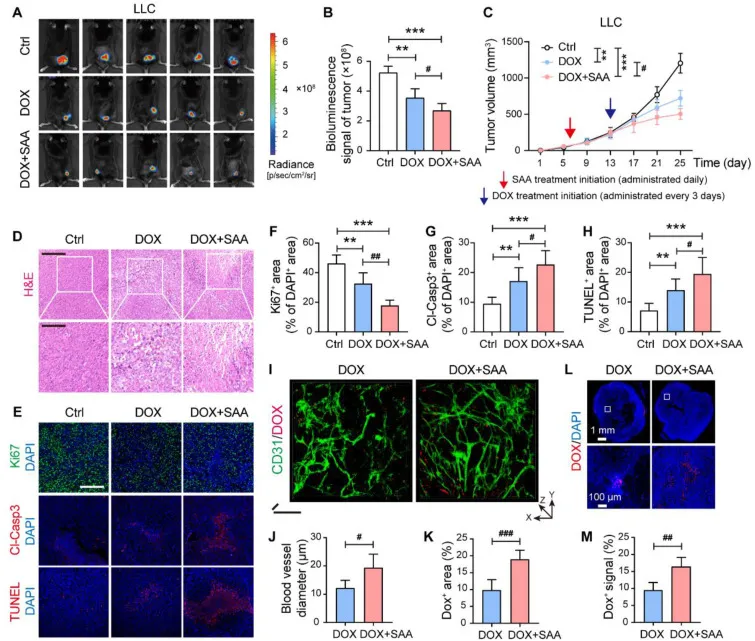
图8 SAA 推动 DOX 进入肿瘤并增强抗肿瘤效果。(A) 使用 Ctrl、DOX (8 mg/kg) 和 DOX + SAA (n = 5) 治疗的 LLC 肿瘤小鼠的体内生物发光图像。(B) LLC 肿瘤中生物发光信号的量化 (n = 5)。(C) LLC 肿瘤的生长曲线 (n = 5)。(D) LLC 荷瘤小鼠的代表性 H&E 染色图像。(E) LLC 荷瘤小鼠中 Ki67(绿色)、Cl-Casp3(红色)和 TUNEL(红色)的代表性免疫荧光染色图像。F–H:LLC 肿瘤中 DAPI+ 细胞的 Ki67+ 细胞 (F)、Cl-Casp3+ 细胞 (G) 和 TUNEL+ 细胞 (H) 的定量 (n = 5)。(I) LLC 肿瘤中 CD31/DOX 的离体双光子显微图像。(J, K) LLC 肿瘤中血管直径 (J) 和 DOX+ 面积 (K) 的定量 (n = 5)。(L,M) LLC 肿瘤中 DOX 分布的代表性图像 (L) 和 DOX+ 信号的量化 (M) (n = 5)。
文章小结
总之,该研究证明抑制EC 中的 PKM2 四聚体可引起肿瘤血管正常化,并减轻缺氧微环境。SAA能够通过直接结合PKM2来改变内皮糖酵解,并通过调节β-Catenin/Claudin-5信号轴来决定内皮TJ的命运。肺癌患者肿瘤内皮中的PKM2表达与肿瘤进展和分化密切相关,可以作为解剖肿瘤血管行为的潜在生物标志物,并似乎成为抗血管生成治疗的新靶点。此外,SAA依靠使肿瘤血管正常化的作用,增强了化疗药物DOX在肿瘤中的渗透和分布,提供了一种新的联合治疗策略。