北京百奥思科生物医学技术有限公司品牌商
8 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
公司新闻/正文
干货分享 | RNA反转录
1076 人阅读发布时间:2023-10-19 09:31
为了研究RNA的功能,通常需要通过反转录过程将RNA转化为更稳定的互补DNA(cDNA)。之后cDNA可通过分子克隆、PCR和测序等技术做进一步的研究。因此,反转录过程是许多RNA实验研究流程的关键步骤。
为了获得更为准确的研究结果,本期总结了反转录过程中需要考虑的一些因素,以期能够抛砖引玉,给你的实验研究带来些许帮助。
本期内容
● RNA模板制备
● 基因组DNA的去除
● 反转录酶选择
● 引物选择
● 主要反应组分
● 反应温度和反应时间
● 第一链和第二链cDNA合成
一、RNA模板制备
RNA是反转录的模板。总RNA通常用于RT-(q)PCR等下游应用的cDNA合成,而特定类型的RNA(如信使RNA(mRNA)、miRNA等小RNA)可通过富集而用于某些实验应用,如cDNA文库构建和miRNA图谱分析。
保持RNA的完整性至关重要,在提取、处理、储存和实验过程中均需要采取特殊的保护措施。防止RNA降解的最佳方法包括佩戴手套、使用具有气溶胶屏障的移液器移液、使用无核酸酶的实验室器具和试剂以及对实验区域进行去污处理。
根据来源材料(如血液、组织、细胞、植物)的类型和实验目标,有多种RNA分离和纯化方法可供选择。分离纯化过程的主要目标是稳定RNA分子、抑制RNA酶,并通过适当的储存和提取方法大程度提高产量。最佳的纯化方法可以去除干扰酶活性的内源性化合物,如植物组织中的复合多糖和腐殖酸,以及反转录酶的常见抑制剂,如盐、金属离子、乙醇和C₆H₆O。纯化的RNA应保存在-80°C,尽量减少反复冻融。
纯化后评估RNA质量和数量的方法有许多种。常用的方法是利用紫外光谱法检测特定波长的吸光度。RNA质量可通过利用Beer-Lambert定律测定260 nm处的吸光度而确定;不同波长的吸光度比值可以确定是否存在特定污染物(表1)。请注意,紫外吸光度不是RNA特有的,所有核酸都可以吸收相近波长的紫外线。对于需要更高RNA特异和更灵敏分析的RNA, 可以考虑使用含染料的荧光试剂,这种试剂只在特异性的与目标分子结合时才会释放荧光信号。
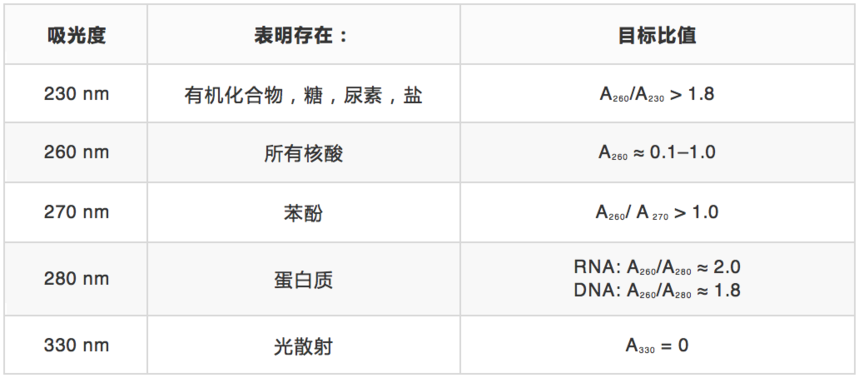
表1. RNA分析的紫外检测指南
以28S和18S核糖体RNA(rRNA)的比值可评估RNA的完整性。将总RNA变性后进行凝胶电泳,可对其进行定性评估。然后,评估28S rRNA与18S rRNA的强度比,比值为2:1代表完整的RNA(图1A)。Agilent Technologies开发的一种方法结合了微流体学和专利算法,可定量评估RNA的完整性。该方法可产生数字读数,称为RNA完整性分数或RIN值,数值介于8至10之间代表高质量的RNA [1,2](图1B)。
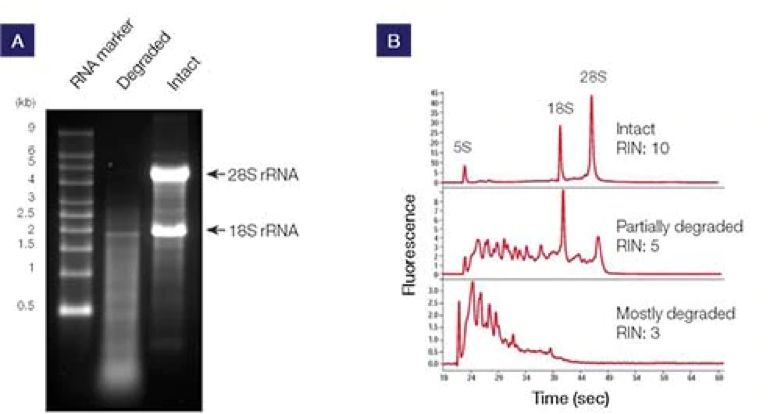
图1. 利用(A)凝胶电泳和(B)微流体学方法进行RNA完整性分析。
二、基因组DNA的去除
某些情况下,痕量基因组DNA(gDNA)可能与RNA共同被纯化。污染gDNA可能会干扰反转录结果,导致RT-qPCR等高灵敏度实验出现假阳性、高背景或检测率降低。
为去除gDNA,通常在RNA分离过程中加入DNase I。在进行RT-(q)PCR之前,必须完全去除DNase I,因为任何残留的酶都会使单链DNA(如引物和cDNA)降解。通常,DNase I失活(如,EDTA和加热处理)或酶去除步骤会导致RNA降解或样品损失。
作为DNase I的替代品,可使用双链特异性DNase去除污染gDNA,而不影响RNA或单链DNA。它们的热分解性质使其在相对温和的温度(如55℃)下即可失活,同时没有负面影响。在反转录反应之前,只需将这种双链特异性DNase与RNA在37℃下孵育2分钟,从而简化实验流程(图2)。
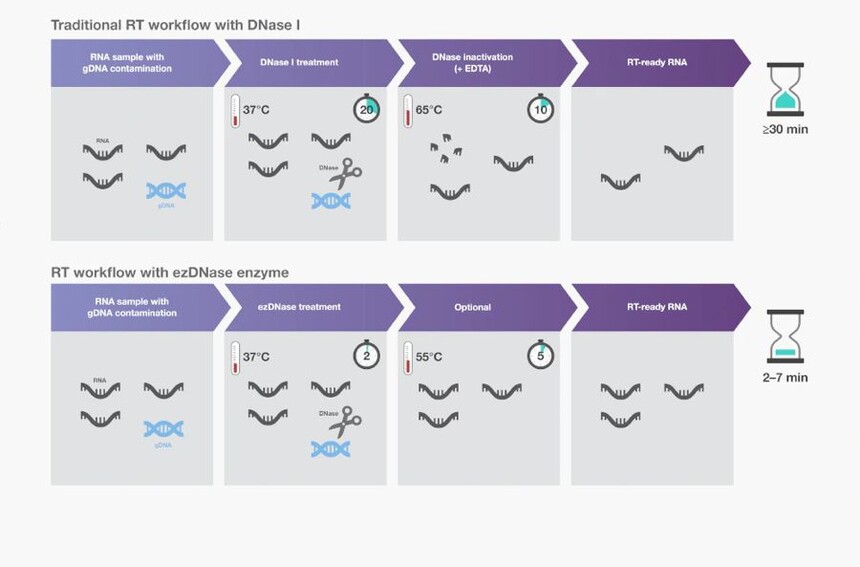
图2. gDNA去除步骤
三、反转录酶选择
反转录酶以RNA为模板合成cDNA,但这一类反转录酶可能具有不同的功能活性和性质。它们的性质会影响其反转录长链RNA、高GC含量RNA、具有复杂二级结构的RNA和不纯RNA的能力。
分子生物学中使用的大多数反转录酶来源于禽成髓细胞瘤病毒(AMV)或莫洛尼鼠白血病病毒(MMLV)的pol基因。AMV反转录酶是实验室中首批用于cDNA合成的酶之一。该酶是一种分子量为170-kDa的异二聚体,最佳反应温度范围为42-48℃。AMV反转录酶具有较强的RNase H活性,可降解RNA:cDNA复合物中的RNA,获得的cDNA片段较短(<5 kb)。
MMLV反转录酶因具有单体结构而成为常用的替代品,可对重组酶进行更简单的克隆和修饰。MMLV反转录酶是一种分子量为75 kDa的酶,反应温度约为37°C。虽然MMLV的热稳定性低于AMV反转录酶,但其RNase H活性较低,因此具有更高的长cDNA(<7kb)合成效率[3]。
为了进一步改善cDNA合成,MMLV反转录酶经过改造具有更低的RNase H活性(即RNase H Minus,将RNase H结构域进行突变)、更高的热稳定性(高达55℃)和更强的持续合成能力(65倍以上)。这些属性改变可增加cDNA长度和产量,提高灵敏性,改善抑制剂耐受性,并缩短反应时间(表2)[4]。
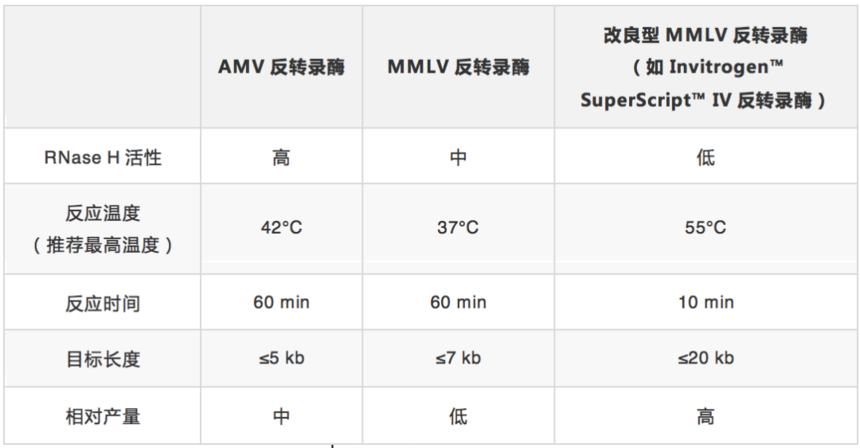
表2. 常用反转录酶及其属性
四、引物选择
为了启动反转录,反转录酶需要一种短DNA寡核苷酸(即引物)与其互补序列在RNA模板上结合,并作为新链合成的起点。根据RNA模板和下游应用,有三种基本类型的引物可供选用:oligo(dT)引物、随机引物和基因特异性引物(图3)。
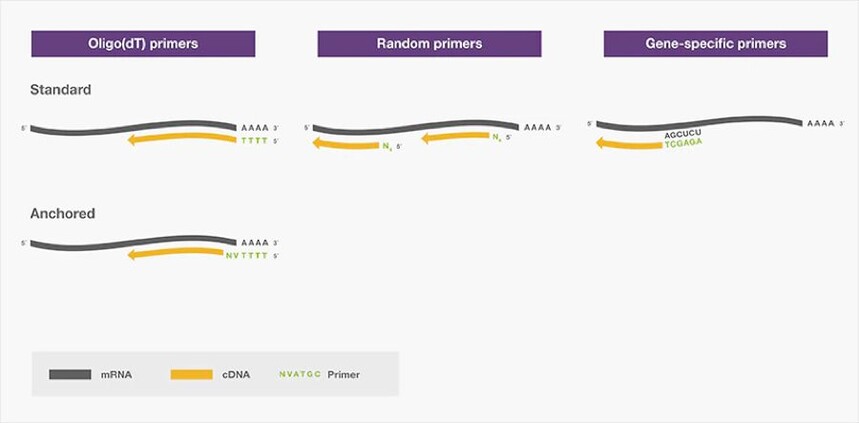
图3. 反转录中的常用引物。
❖ Oligo(dT)引物由12-18个脱氧胸腺核苷酸组成,可与真核mRNA的poly(A) 尾退火。其为从真核生物mRNA构建cDNA文库、全长cDNA克隆和cDNA 3'末端快速扩增(3'RACE)的最佳选择。由于oligo(dT)引物对poly(A) 尾的特异性,其不适用于降解的RNA,如来自FFPE样品的RNA,也不适用于缺少poly(A) 尾的RNA,如原核生物RNA和microRNA。由于cDNA合成开始于3' poly(A)尾,oligo(dT)引物可能引起3'末端偏差。具有复杂二级结构的RNA也可能影响全长cDNA合成,导致5'末端的代表性偏低。
通过修饰Oligo(dT)引物,可以提高反转录效率。例如,Oligo(dT)引物的长度可以延伸到20个核苷酸或更长,使其在较高温度下退火。在一些情况下,Oligo(dT)引物可能包括3'末端的多义碱基,如dN(dA,dT,dG或dC)和dV(dG,dA或dC)。该修饰可防止poly(A)滑移,并且将起始位点锁定在poly(A)尾的上游位置。这些引物被称为锚定oligo(dT)。
❖ 随机引物是具有随机碱基序列的寡核苷酸,通常由6个核苷酸组成,被称为随机六聚体、N6或dN6。由于随机引物的随机结合(即没有模板特异性),其可以退火到样本中的任何类型RNA。因此,这些引物被认为可以用于无poly(A)尾结构(如rRNA、tRNA、非编码RNA、小RNA、原核mRNA)的RNA、降解RNA(如来自FFPE组织的RNA)和具有已知二级结构的RNA(如病毒基因组)的反转录。
虽然随机引物有助于改善cDNA合成,但它们不适合用于长RNA的全长反转录。增加随机六聚体引物的浓度可提高cDNA产量,但同时也会增加相同模板上与多个位点的结合,从而导致cDNA片段较短(图4)。
此外,随机引物可能不适用于某些RT-PCR应用。例如,高估mRNA拷贝数就是一个需要考虑的问题[5]。两步法RT-PCR经常使用oligo(dT)和随机引物的混合物,结合每种类型引物的优点。在microRNA(miRNA)表达检测中,随机六聚体并不适用,必须为miRNA的反转录设计特殊引物[6,7]。
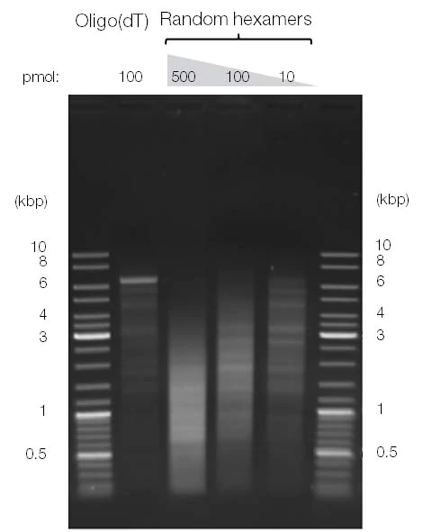
图4. cDNA的长度和产量受到所选择引物和引物浓度的影响。使用oligo (dT)引物和不同浓度的随机六聚体引物,将具有poly(A)尾的6.4 kb RNA反转录成双链cDNA。通过琼脂糖凝胶电泳分析结果可以看到,使用oligo(dT)引物可获得更分散、更长的转录产物,相比之下,增加随机六聚体的浓度,可产生更高浓度的短cDNA。
❖ 基因特异性引物可提供特异性最强的反转录引物配对。这些引物是根据目标RNA的已知序列进行设计的。由于引物与特异性RNA序列结合,每个目标RNA都需要一套新的基因特异性引物。因此,当对多种目标进行分析时,则需要使用更多的RNA样本。基因特异性引物通常用于一步RT-PCR实验应用。
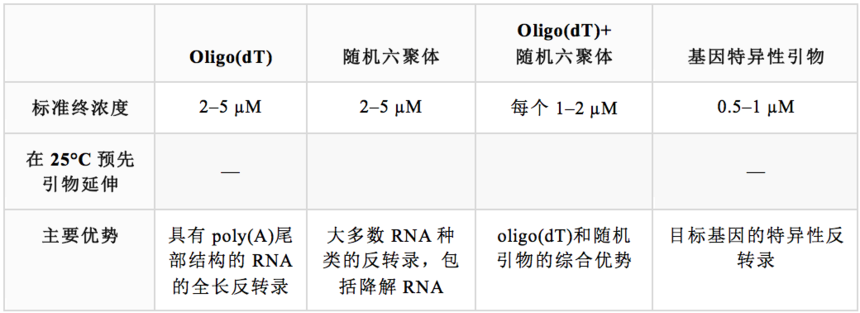
表3. 常用反转录引物的对比
五、主要反应组分
除了反转录酶和引物之外,其它主要反应组分还包括RNA模板(预处理以去除基因组DNA)、缓冲液、dNTP、DTT、RNA酶抑制剂和RNase-free水(图5)。
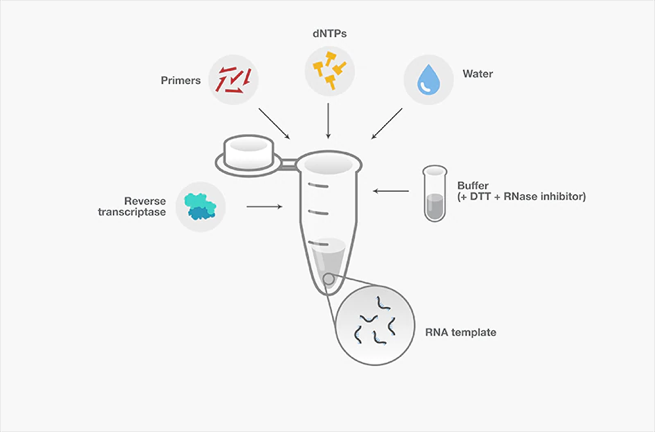
图5. 反转录反应及其主要组分。
❖ RNA模板按本文前述方法制备。表4提供了反转录反应的推荐RNA起始量范围,最佳起始量取决于目标序列的普遍性和反转录酶的灵敏性。
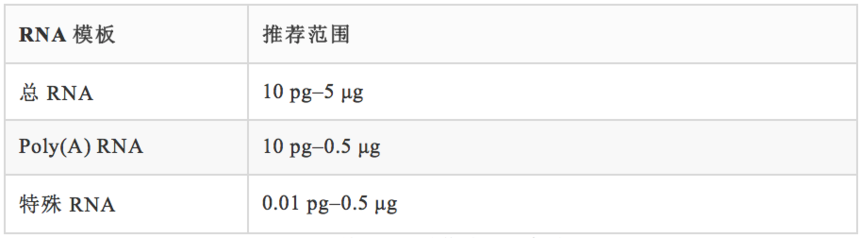
表4. 反转录反应的推荐RNA起始量范围
❖ 反应缓冲液可维持反应的最佳pH和离子强度。提供的缓冲液还可能含有提高反转录效率的添加剂。
❖ dNTPs通常为0.5-1 mM,最好为等摩尔浓度。推荐使用新鲜稀释的高品质dNTP,以确保良好的反转录效果。
❖ DTT,一种还原剂,通常用于提供最佳的酶活性。如果DTT或其他添加剂发生沉淀,会降低反应效率;因此,应溶解反应组分并充分混匀。
❖ RNA酶抑制剂通常包含在反应缓冲液中或单独被添加到反转录反应中,用于防止RNA降解。RNase可能在RNA分离过程中被共同纯化,或者在反应体系配制期间被引入。已知的RNase有许多种,应根据其作用方式和反应要求选择合适的RNA酶抑制剂。
❖ 反转录反应中使用的水应不含有核酸酶。最好选用商业化供应的无核酸酶水,或经DEPC处理去除RNase的水。污染RNase不能通过简单的过滤去除,而且由于RNase是热稳定的,无法通过高压消毒去除。
六、反应温度和反应时间
反转录反应包含三个主要步骤:引物退火、DNA聚合和酶失活(图6)。这些步骤的温度和持续时间因选择的引物、目标RNA和使用的反转录酶而异。
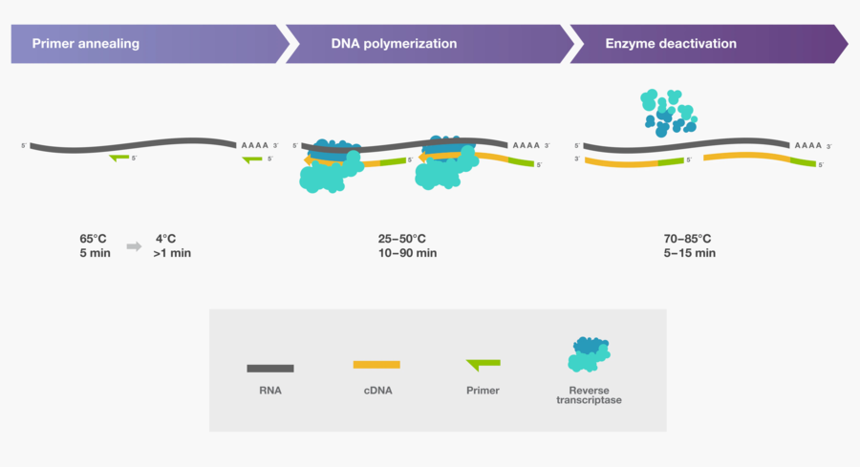
图6. cDNA合成的三个主要步骤。
❖ 引物退火:将引物与RNA模板混合,加热至65℃并维持5分钟,然后冰浴至少1分钟。这有助于确保RNA保持单链以及引物与靶标有效退火。退火后,加入反转录酶和必需组分(如缓冲液、dNTPs、RNA酶抑制剂)。
❖ DNA聚合:在此步骤中,反应温度和持续时间可能会根据所使用的引物和反转录酶而变化。使用oligo (dT)引物(Tm〜35-50 ℃),可以在反转录酶的最佳反应温度(37-50 ℃)下直接孵育反应。随机六聚体引物因其较短的长度,通常具有较低的Tm(〜10-15℃)。因此,当使用随机六聚体引物(单独使用或与oligo(dT)结合使用)时,我们建议在加入酶后,在室温(〜25℃)孵育10分钟以延伸引物。
反转录酶的热稳定性各不相同,而热稳定性决定了每种酶的最佳聚合温度。使用热稳定的反转录酶,可达到更高的反应温度(如50 ℃),有助于高GC或具有复杂二级结构RNA的变性,同时不影响酶活性(图7)。
聚合时间取决于反转录酶的持续合成能力,即单次合成过程中掺入的核苷酸数量。例如,持续合成能力较低的野生型MMLV反转录酶通常需要60多分钟才能完成cDNA合成。相比之下,持续合成能力较高的改良型反转录酶可能只需要10分钟时间,就可以合成9 kb cDNA。
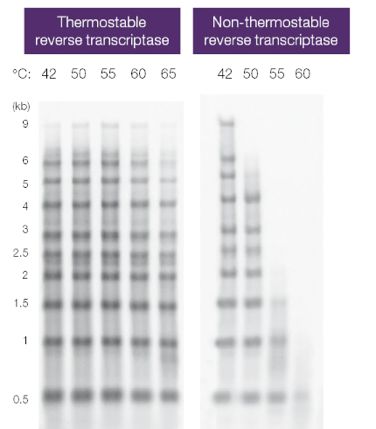
图7. 热稳定性对反转录酶活性的影响。使用oligo(dT)引物和放射性标记dNTPs,对含有不同长度RNA的样本进行反转录。通过凝胶电泳分离反应产物,并通过放射自显影进行显色。热稳定的反转录酶即使在50℃以上也能得到高cDNA产量。
❖ 酶失活:反转录反应的最后一步是将反转录酶失活处理。失活温度范围为70-85 ℃,具体取决于酶的热稳定性。失活通常需要5-15分钟,温度越高,所需时间越短。
七、第一链和第二链cDNA合成
如前所述,从RNA模板合成cDNA,产生cDNA:RNA复合物。该过程被称为第一链cDNA合成。如果存在RNase H活性(如野生型AMV和MMLV反转录酶),则cDNA:RNA复合物中的RNA会在第一链合成期间被切割。第一链cDNA可以直接用于RT-PCR等实验应用中,热稳定DNA聚合酶(如Taq DNA聚合酶)将复制cDNA的互补链。
在cDNA文库构建和测序中,将第一链cDNA作为模板,获得代表RNA靶标的双链cDNA。这个过程被称为第二链cDNA合成。在第二链cDNA合成中,推荐使用RNase H活性最小的反转录酶,从而最大限度地增加cDNA合成长度和产量。
双链cDNA的合成可以使用多种DNA聚合酶(如T7 DNA聚合酶、DNA聚合酶I、Taq DNA聚合酶)生成cDNA第一链的互补链。以下列举的一些其它酶也可按照Gubler-Hoffman改良方法[8](图8)用于双链cDNA合成。
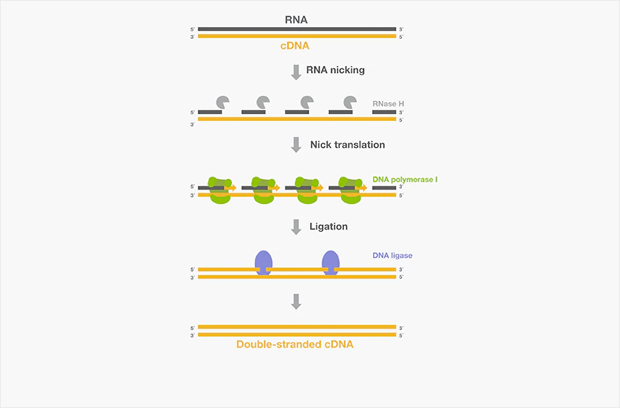
图8. 利用Gubler-Hoffman方法进行双链cDNA合成。
❖ E. coli RNase H切割cDNA:RNA复合物中的RNA链,为DNA合成提供3'-OH引物结合位点
❖ E. coli DNA polymerase I利用5′-3′'聚合酶活性延伸切口RNA链,并利用5'-3'外切核酸酶活性沿合成方向替换RNA链,该过程被称为切口平移。
❖ E. coli DNA ligase缝合新合成cDNA片段之间的切口。(T4 DNA连接酶不能用作替代物,因为它会连接钝端双链cDNA片段并形成嵌合结构。)
❖ T4 DNA polymerase可将双链cDNA的末端平端化(最后一步,可选)。
总之,反转录实验的成功高度依赖于反应组分和反应条件。以上为关于反转录的一些总结,希望能给大家的实验带来些许帮助。最后,祝大家实验顺利!